Вихідний: субота, неділя
- Імунодепресивні препарати
- Імуностимулятори
- Інше
- Антибактеріальні препарати
- Антидепресанти
- Вітаміни
- Гомеопатичні засоби
- Гормональні препарати
- Дерматологія
- Дихальна система
- Кровотворна система
- Мочестатева система
- Нервова система
- Онкологія
- Опорно-рухова система
- Препарати для лікування захворювань органів чуття
- Протиалергічні препарати
- Протигрибкові препарати
- Протиепілептичні препарати
- Протипухлинні препарати
- Серцево-судинна система
- Спазмолітичні засоби
- Суплемент дієти
- Хвороба Альцгеймера
- Хвороба Крона
- Хвороба Паркінсона
- Цукровий діабет
- Шлунково-кишковий тракт та обмін речовин
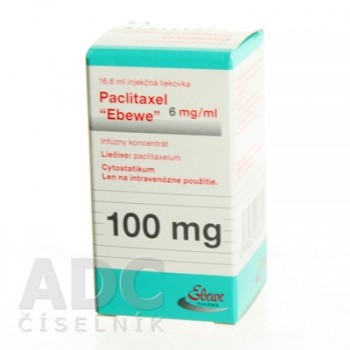
Паклітаксел (Paclitaxel) Ебеве 6 мг/мл 16.7 мл/100 мг, 1 флакон
ПАКЛІТАКСЕЛ ЕБЕВЕ (PACLITAXEL EBEWE)
Загальна характеристика:
міжнародна та хімічна назви: паклітаксел;
основні фізико-хімічні властивості: прозорий, світло-жовтий розчин;
склад: 1 мл розчину містить 6,00 мг паклітакселу;
допоміжні речовини: олія поліоксильна касторова, етанол безводний.
Форма випуску. Концентрат для приготування розчину для інфузій.
Фармакотерапевтична група. Препарати для лікування онкологічних захворювань. Цитостатичні препарати. Код АТС L01C D01.
Фармакологічні властивості.
Фармакодинаміка. Паклітаксел є антимітогеном рослинного походження, що діє на мікротрубочковий апарат клітини. Він стимулює складаннямікро трубочок з димерів тубуліну і стабілізує їх, запобігаючи де полімеризації. Внаслідок цього порушується нормальний процес динамічної реорганізаціїмікротрубочкових мереж, важливий для клітинних функцій. Окрім того, паклітакселіндукує утворення аномальних структур або “зв’язок” мікро трубочок протягом клітинного циклу, а також множинних “зірок” з мікро трубочок під час мітозу.
Фармакокінетика. Після внутрішньо венного введення спостерігається двофазне зниження концентрації паклітакселу в плазмі крові.
Фармакокінетика паклітакселу вивчалася після вливання препарату в дозах 135 мг/м2 і 175 мг/м2 протягом 3 і 24 годин. Середня тривалість періоду напів виведення під час термінальної фази становила 3,0-52,7 години, асередній загальний кліренс з організму – 11,6-24,0 л/год·м2. Спостерігалася тенденція до зниження загального кліренсу паклітакселу з організму при підвищенні його концентрації у плазмі крові. Середній рівноважний об’єм розподілу паклітакселу становив 198-688 л/м2, що свідчить про широкий екстраваскулярний розподіл і (або) зв’язування з тканинами. Приінфузіях тривалістю 3 години фармакокінетика паклітакселу мала нелінійний характер. При збільшенні доз на 30% (з 135 мг/м2 до 175 мг/м2) максимальна концентрація Сmax і площа під графіком “концентрація -час” AUC0-a збільшилися відповідно на 75% і 81%.
Коливання рівнів системної експозиції паклітакселу під час різних курсів терапії були мінімальними. Кумуляції паклітакселу при багаторазових курсах лікування зафіксовано не було.
Результати досліджень in vitro свідчать, що 89-98% паклітакселузв’язується з білками плазми. Присутність циметидину, ранітидину, дексаметазонуабо дифенілгідраміну не впливає на зв’язування паклітакселу з білками.
Метаболізм паклітакселу у людини ще не повністю вивчений. Із сечею в незміненому вигляді виводиться від 1,3% до 12,6% від введеної дози, що свідчить про екстенсивний не нирковий кліренс. Паклітаксел метаболізується переважно впечінці і виводиться головним чином через жовч. Ймовірно, що метаболізаціяпаклітакселу відбувається за участі ізоферментів цитохрому Р 450. Після введенняпаклітакселу, поміченого радіо активним ізотопом, 26%, 2% і 6% радіо активності були виведені з фекаліями у вигляді 6a-гідроксипаклітакселу,3’-р-дигідроксипаклітакселу та 6a-3’-р-гідроксипаклітакселу. Утворення цихгідроксильованих метаболітів каталізується, відповідно, ізоферментами CYP2C8,CYP3A4 і CYP2C8 та CYP3A4 одночасно. Вплив порушень функцій нирок і печінки наметаболізм паклітакселу при 3-годинних інфузіях формально не вивчався. Фармакокінетичні показники в одного пацієнта, що потребував гемодіалізу і отримував паклітаксел у дозі 135 мг/м2 шляхом 3-годинних вливань, не відрізнялися від показників у пацієнтів без порушень функції нирок.
Показання для застосування.
Рак яєчника. Паклітаксел застосовується як препарат першої лінії для лікування раку яєчника, а також у комбінації з цисплатином при розповсюдженій формі раку яєчника або при залишкових пухлинах після лапаротомії розміром більше 1 cм. Паклітаксел застосовується як препарат другої лінії для лікування метастатичного раку яєчника, якщо стандартна терапія препаратами платини виявилася неефективною.
Рак молочної залози. Паклітаксел застосовується для лікування метастатичного раку молочної залози, якщо стандартна терапія препаратамиантрациклінового ряду протипоказана або виявилася неефективною.
Не дрібноклітинний рак легені. Паклітаксел у комбінації з цисплатиномвикористовується для лікування не дрібноклітинного раку легені у разі неможливості застосування хірургічних методів і (або) променевої терапії.
Саркома Капоші у хворих на СНІД.
Спосіб застосування та дози.
Рекомендовані дози для дорослих і людей похилого віку
Первинне лікування раку яєчника. Комбінована схема: паклітаксел у дозі 135 мг/м2, введення шляхом внутрішньо венного вливання тривалістю понад 24 години, потім введення цисплатину у дозі 75 мг/м2. Інтервал між курсами – 3 тижні.
Вторинне лікування раку яєчника і раку молочної залози. Паклітаксел удозі 175 мг/м2, введення шляхом внутрішньо венного вливання тривалістю 3 години. Інтервал між курсами – 3 тижні.
Лікування не дрібноклітинного раку легені. Комбінована схема: паклітаксел у дозі 175 мг/м2, введення шляхом внутрішньо венного вливання тривалістю 3 години, потім введення цисплатину у дозі 80 мг/м2. Інтервал між курсами – 3 тижні.
Лікування саркоми Капоші. Паклітаксел у дозі 135 мг/м2, введення шляхом внутрішньо венного вливання тривалістю 3 години. Інтервал між курсами – 3 тижні.
Наступні дози паклітакселу повинні коригуватися залежно від індивідуальної реакції пацієнтів. Повторні введення можливі лише після збільшення кількості нейтрофілів до рівня => 1,5 x 109/л, а тромбоцитів – до рівня => 100 x 109/л. Хворим, у яких спостерігалася тяжка нейтропенія (кількість нейтрофілів була нижчою за 0,5 x 109/лпротягом 7 днів і більше) або тяжка периферична нейропатія, наступні дози слід зменшувати на 20%.
Всі пацієнти повинні отримувати премедикацію кортикостероїдами, антигістамінними препаратами і антагоністами H2-рецепторів, наприклад, за такою схемою:
|
Препарат |
Доза |
Час прийому |
|
Дексаметазон |
20 мг перорально |
за 12 і за 6 годин до введення паклітакселу |
|
Дифенгідрамін або хлорфенірамін |
50 мг в/в 10 мг в/в |
за 30-60 хвилин до введення паклітакселу |
|
Циметидин або ранітидин |
300 мг в/в 50 мг в/в |
за 30-60 хвилин до введення паклітакселу |
Лікування дітей
Ще не визначено, в яких дозах паклітаксел може вводитися дітям.
Інструкції медичному персоналу
При роботі з Паклітакселом “Ебеве", як і з іншими цито токсичними препаратами, необхідна обережність. Приготуванням розчинів для інфузій має займатися підготовлений персонал, в спеціально відведеній зоні, з додержанням усіх правила септики. Необхідно користуватися захисними рукавичками. Слід уникати потрапляння розчинів паклітакселу на шкіру та слизові оболонки. Якщо це все жтрапилось, уражені ділянки шкіри слід промити водою з милом. У цих місцях можливе поколювання, жар і почервоніння шкіри. При потраплянні препарату наслизові оболонки їх необхідно ретельно промити водою. При вдиханні розчинівпаклітакселу можливі задишка, біль у грудях, печіння в горлі та нудота.
Невикористані розчини, інструменти та матеріали, що були в контакті зпаклітакселом, мають знищуватися згідно з установ леною процедурою утилізації відходів, що містять цитотоксичні речовини.
Приготування ін фузійних розчинів для внутрішньо венного введення
Перед застосуванням концентрат для приготування розчину для інфузійПаклітаксел “Ебеве” необхідно розвести, додержуючись правил асептики. Концентрат розводиться 0,9% розчином хлориду натрію, 5% розчином глюкози або 5% розчином глюкози в 0,9% розчині хлориду натрію до кінцевої концентрації 0,3-1,2мг/мл. При кімнатній температурі (близько 25 °C) і кімнатному освітленні розведені розчини є фізично і хімічно стабільними протягом 48 годин (включаючи час приготування і введення). Розведені розчини не слід зберігати в холодильнику.
Приготовані розчини для інфузій можуть бути каламутними, що зумовлено складом основи-носія. Фільтрація не дозволяє ліквідувати цю каламутність. Розчини паклітакселу необхідно вводити через вбудовані в інфузійні системи мембранні фільтри з розміром пор <= 0,22 мкм. При введенні через такусистему помітних втрат активності діючої речовини не спостерігається.
Щоб мінімізувати вилуговування диетил гексилфталату (DEHP) з ін фузійнихмішків, систем або іншого медичного обладнання з пластифікованого полівінілхлориду, розведені розчини для інфузій слід зберігати в посуді з матеріалів, що не містять ПВХ (пляшках зі скла, поліпропілену, мішках з поліпропілену, поліолефіну) і вводити через інфузійні системи з поліетилену. Фільтри можуть підключатися короткими трубками з полівінілхлориду, це не спричиняє значного вилуговування DEHP.
Побічна дія.
Частота й інтенсивність побічних ефектів у хворих на рак яєчника, рак молочної залози та не дрібноклітинний рак легені суттєво не відрізняються.
Нижче наведені відомості стосовно побічних ефектів, зафіксованих підчас III фази клінічних досліджень при моно терапії паклітакселом у дозі 175 мг/м2у вигляді 3-годинних інфузій хворих на рак яєчника і рак молочної залози.
Побічні ефекти при комбінованій терапії паклітакселом і препаратами платини вивчались у ході великого рандомізованого дослідження на хворих на рак яєчника (24-годинні інфузії, GOG-111), а також під час клінічних випробувань урамках III фази на хворих на не дрібноклітинний рак легені (3-годинні інфузії). Профілі безпеки при комбінованій терапії або тривалих вливаннях (понад 24години) і при моно терапії паклітакселом суттєво не відрізнялися, за винятком деяких зазначених нижче відмінностей.
Най поширенішим побічним ефектом при лікуванні паклітакселом було пригнічення функції кісткового мозку. Тяжка (але не фебрильна) нейтропенія (< 0,5 x 109/л) спостерігалася у 28% пацієнтів. Лише в 1% хворих тривалість тяжкої нейтропенії перевищувала 7 діб.
У 24% пацієнтів були відмічені інфекційні епізоди. Під час клінічних досліджень у рамках фази III були зафіксовані два випадки фатальних інфекцій при застосуванні паклітакселу в рекомендованих дозах і за рекомендованих схем введення.
Тромбоцит опенія спостерігалася в 11% хворих. У 3% пацієнтів під час лікування було відмічене щонайменше одноразове зниження кількості тромбоцитів до рівня < 50 x 109/л.
Анемія спостерігалась у 64% пацієнтів, а тяжка анемія (Hb < 5ммоль/л) – у 6% хворих. Частота епізодів і тяжкість анемії залежали відвихідних рівнів гемоглобіну.
Не під час III фази клінічних випробувань був зафіксований один випадок гострої мієлоїдної лейкемії і один випадок мієлодиспластичного синдрому.
Мієлосупресія спостерігалася рідше і була менш вираженою при 3-годинних вливаннях порівняно з 24-годинними. Комбінована терапія паклітакселом іцисплатином спричинювала більш тяжке пригнічення функції кісткового мозку, ніжпри моно терапії паклітакселом у дозі 175 мг/м2 і тривалості інфузій 3 години, однак збільшення кількості клінічних ускладнень при цьому не спостерігалося.
Тяжкі реакції гіпер чутливості з можливими фатальними наслідками (дояких належать гіпотензія, що вимагає терапевтичного втручання, ангіо невротичнийнабряк, порушення функції дихання, що вимагають застосування бронходилататорів, генералізована кропив’янка) були зафіксовані у двох пацієнтів (< 1%). У 34пацієнтів (17%) спостерігалися незначні реакції, головним чином припливи та висипання, які не вимагали терапевтичного втручання і відміни терапіїпаклітакселом.
Гіпотензія і брадикардія спостерігались у 22% і 5% пацієнтів відповідно. В більшості випадків зміни були незначними і не вимагали терапевтичного втручання.
У 17% хворих під час клінічних випробувань були зафіксовані відхилення на ЕКГ. У більшості випадків не було чіткого зв’язку між застосуваннямпаклітакселу і змінами ЕКГ, а самі зміни не були клінічно значущими або мали мінімальне клінічне значення.
В одного пацієнта (< 1%) під час терапії паклітакселом була відмічена гіпертензія, а у двох пацієнтів (< 1%) – тяжкі тромботичні епізоди (тромбоз судин верхніх кінцівок і тромбофлебіт). Значні порушення діяльності серцево-судинної системи – гіпотензія внаслідок септичного шоку (1 пацієнт), кардіоміопатія (1 пацієнт) і тахікардія з пропасницею (1 пацієнт) були відмічені менше, ніж у 1% хворих. На початкових стадіях клінічних випробувань, при експериментах з різними дозами і схемами введення, у 2% пацієнтів були зафіксовані тяжкі порушення діяльності серцево-судинної системи, можливо, пов’язані з паклітакселом (а симптоматична шлуночкова тахікардія, тахікардія збігемінією, атріовентрикулярна блокада, синкопи). Ці явища частішеспостерігались у хворих на не дрібноклітинний рак легені.
Зафіксовані поодинокі випадки інфарктів міокарда. Застійна серцева недостатність спостерігалася переважно у пацієнтів, які раніше отримували іншівиди хіміотерапії, особливо антрацикліни.
Периферична нейропатія, що виявлялася головним чином у парестезії, спостерігаласьу 66% пацієнтів, однак тяжкий характер вона мала лише у 5% хворих. У хворих нане дрібноклітинний рак легені тяжка периферична нейропатія спостерігалася дещо частіше (у 6%). Периферична нейропатія може розвинутися після першого ж курсу лікування і посилюватися після наступних введень паклітакселу. Вона була причиною відміни терапії паклітакселом у 3 випадках. Сенсорна симптоматика звичайно послаблювалась або зникала через декілька місяців після припинення лікування паклітакселом. Існуюча нейропатія внаслідок попередньої терапії не є протипоказанням для лікування паклітакселом.
Не під час зазначених клінічних досліджень у пацієнтів також були зафіксовані великі епілептичні напади (grand mal), енцефалопатія, моторнанейропатія з невеликою атрофією дистальної мускулатури, автономна нейропатія, що призвела до паралітичної непрохідності кишечнику, а також ортостатичнагіпотензія. Також є повідомлення про пошкодження зорового нерва і розлади зору (миготлива скотома), особливо після терапії паклітакселом у дозах, що перевищували рекомендовані. Звичайно ці зміни були оборотними.
Артралгія або міалгія спостерігалася приблизно у 60% пацієнтів, а їхтяжкі форми – у 13% хворих.
Алопеція спостерігалася практично в усіх пацієнтів.
Були зафіксовані транзиторні незначні зміни стану нігтів і шкіри. Є поодинокі повідомлення про аномальну реакцію шкіри на опромінення після терапіїпаклітакселом (ці дані були отримані не під час зазначених випробувань у рамках фази III).
Побічна дія паклітакселу на шлунково-кишковий тракт була незначною або посередньою. Нудота і блювання, діарея та запалення слизових оболонок спостерігалися відповідно у 43%, 28% і 18% пацієнтів. Під час інших клінічних досліджень поза рамками фази III також були зафіксовані обструкція і перфорація кишечнику, тромбоз судин брижі, ішемічний коліт.
Значне підвищення (у 5 разів і більше порівняно з нормою) рівніваспартатамінотрансфер ази (АСТ), лужної фосфатази і білірубіну спостерігалося відповідно у 5%, 4% і < 1% пацієнтів. Також були повідомлення про некроз печінки і печінкову енцефалопатію у пацієнтів, які лікувалися паклітакселом.
Місцеві реакції. В місцях ін’єкцій може спостерігатися локальний набряк, біль, еритема та індурація. Випадкова екстравазація може спричинитицелюлит. Можливі зміни пігментації шкіри. Є поодинокі повідомлення про рецидиви шкірних реакцій в місцях попередньої екстравазації паклітакселу після наступних введень препарату. Специфічні методи лікування реакцій, зумовленихекстравазацією, поки що невідомі.
Зафіксовані випадки радіаційного пневмоніту у пацієнтів, які паралельно проходили курс променевої терапії.
До клінічні дані щодо безпеки. Канцерогенний потенціал паклітакселу не досліджувався. Однак, враховуючи механізм його дії, ймовірно, паклітаксел є канцерогенним і генотоксичним. Дослідження in vitro та in vivo виявили мутагенну дію паклітакселу на ссавців.
Протипоказання.
Гіпер чутливість до паклітакселу або інших компонентів препарату (особливо поліоксильної касторової олії).
Вагітність і лактація.
Нейтропенія (вихідна кількість нейтрофілів < 1500/мм3).
Передозування.
Антидот паклітакселу невідомий. У разі передозування можна очікувати пригнічення функції кісткового мозку, периферичних нейротоксичних уражень і запалення слизових оболонок.
Особливості застосування.
Лікування паклітакселом має здійснюватися під наглядом кваліфікованого лікаря, який має досвід застосування протипухлинних хіміотерапевтичних засобів. Оскільки можливі реакції гіпер чутливості, в наявності має бути відповідне реанімаційне обладнання.
Перед введенням паклітакселу пацієнти повинні отримувати премедикаціюкортикостероїдами, антигістамінними препаратами і антагоністами H2-рецепторів. При комбінованому застосуванні разом з цисплатином паклітаксел слід вводити доцисплатину.
Після премедикації тяжкі реакції гіпер чутливості (що виявляються увигляді задишки та гіпотензії і вимагають терапевтичного втручання, ангіо невротичного набряку, генералізованої кропив’янки) спостерігаються менш, ніж у 1% пацієнтів. Імовірно, ці реакції є гістамін опосередкованими. У разі тяжких реакцій гіпер чутливості вливання паклітакселу необхідно негайно припинити і почати симптоматичне лікування. Повторно таким пацієнтампаклітаксел не повинен призначатися.
Пригнічення функції кісткового мозку (що виявляється переважнонейтропенією) є головним дозолімітую чим фактором. Під час лікуванняпаклітакселом необхідно через короткі проміжки часу визначати кількість формених елементів крові. Повторні введення препарату дозволяються тільки після збільшення кількості нейтрофілов до рівня => 1,5 x 109/л, а тромбоцитів – => 100 x 109/л.
Тяжкі порушення провідності серця при лікуванні паклітакселомспостерігаються рідко. У разі значних порушень провідності призначається відповідне лікування, а під час наступних введень паклітакселу проводиться безперервний моніторинг роботи серцевої системи. В усіх інших пацієнтів рекомендується часто контролю вати головні показники життєдіяльності, особливо впершу годину введення паклітакселу.
Під час введення паклітакселу можлива гіпотензія, гіпертензія і брадикардія. Звичайно вони а симптоматичні і не вимагають лікування. Тяжкі порушення роботи серцево-судинної системи частіше спостерігаються у хворих нане дрібноклітинний рак легені, ніж у хворих на рак молочної залози або яєчника.
Хоча периферична нейропатія є частим побічним ефектом при лікуванніпаклітакселом, її тяжкі форми спостерігаються рідко. В серйозних випадках рекомендується знижувати на 20% всі наступні дози паклітакселу. У хворих нане дрібноклітинний рак легені частота тяжких нейротоксичних уражень при комбінованому лікуванні паклітакселом і цисплатином вища, ніж при моно терапіїпаклітакселом.
Паклітаксел не рекомендується призначати пацієнтам з тяжкими порушеннями функції печінки.
Оскільки Паклітаксел “Ебеве” містить етанол, слід враховувати його можливий вплив на ЦНС, а також інші ефекти.
Вагітність і лактація
Експерименти на кроликах показали, що паклітаксел є ембріотоксичним іфетотоксичним. Також паклітаксел знижує фертильність у пацюків. Для людини відповідних відомостей немає, але ймовірно, що паклітаксел, як і інші цитотоксичні препарати, може вадити плоду у разі застосування в період вагітності. Паклітаксел не можна призначати в період вагітності, а жінкам слід стерегтися запліднення в період лікування паклітакселом і негайно інформувати лікаря, якщо це все ж сталося.
Невідомо, чи виводиться паклітаксел з материнським молоком. Тому підчас лікування паклітакселом годування груддю має бути припинене.
Вплив на здатність керувати транспортними засобами та механізмами
Оскільки Паклітаксел “Ебеве” містить алкоголь, він може впливати на здатність керувати транспортними засобами та механізмами.
Взаємодія з іншими лікарськими засобами.
Премедикація циметидином не впливає на кліренс паклітакселу.
При комбінованому лікуванні паклітакселом і цисплатином раку яєчникапаклітаксел рекомендується вводити до цисплатину. В цьому разі профіль безпеки такий самий, як і при моно терапії паклітакселом. Якщо ж паклітаксел вводиться після цисплатину, спостерігається більш тяжка мієлосупресія, а кліренспаклітакселу знижується приблизно на 20%.
Метаболізм паклітакселу частково каталізується ізоферментами CYP2C8 іCYP3A4 цитохрому Р 450. Клінічні дослідження продемонстрували, що головною метаболічною трансформацією у людей є CYP2C8-опосередковане перетворенняпаклітакселу у 6a-гідроксипаклітаксел. Клінічно значущої взаємодії з іншими ферментами, за винятком CYP2C8, не очікується. Паралельний прийом кетоконазолу, потужного інгібітору CYP3A4, не уповільнює виведення паклітакселу з організму, тому обидва препарати можна застосовувати одночасно, без корекції доз. Проте, оскільки відомостей стосовно взаємодії паклітакселу з іншими субстратами, індукторами та інгібіторами CYP3A4 недостатньо, при одночасному застосуванні цих препаратів необхідна обережність.
Несумісність
Поліоксильна касторова олія, що входить до складу Паклітакселу“Ебеве", може вилуговувати диетил гексилфталат (DEHP) з пластифікованого полівінілхлориду. Інтенсивність цього процесу залежить від тривалості дії і концентрації касторової олії. Тому при розведенні, зберіганні і введенні препарату слід користуватись обладнанням, що не містить полівінілхлориду.
Умови та термін зберігання. Зберігати при кімнатній температурі, не вище 25 °C, у темному, недоступному для дітей місці.
Термін придатності – 24 місяці.
Після відкриття флакона концентрат для приготування розчину для інфузійПаклітаксел “Ебеве” є стабільним протягом 28 діб у разі зберігання при кімнатній температурі (25 °C) у незахищеному від світла місці.
Після розведення 0,9% розчином хлориду натрію або 5% розчином глюкози розчини для інфузій є фізично і хімічно стабільними протягом 48 годин у разі зберігання при температурі 25 °C. Їх не слід охолоджувати, оскільки при цьому може утворюватись осад.
З мікро біологічної точки зору, препарат слід використовувати негайно. Якщо ін фузійний розчин не був використаний відразу ж, за терміном і умовами його зберігання має стежити користувач.
Написати відгук
Ваше Ім’я:
Ваш відгук: Увага: HTML не підтримується! Використовуйте звичайний текст.
Оцінка: Погано Добре
Введіть код, вказаний на зображенні: